NO自然氧化速率常数
- 2025-02-05 08:09:00
- 管理员 原创
- 807
NO自然氧化速率常数
NO 的性质比较稳定,但在空气中会被O2氧化为NO,反应机理如下:
2NO + O2→ 2NO,△H=-144KJ/mol
在一定温度范围内,NO 氧化反应的转化率受到热力学平衡的控制,其反应平衡常数Kp与温度T的关系,如下:
常压下NO 氧化反应的转化率(NO2/NOx)与温度T关系曲线,如图 1 所示。图1 不同氧分压下NOx氧化度与温度的关系曲线由图可知,低温下NO2较NO稳定,高温下,NO 处于稳定状态。由热力学平衡研究可知,在低温条件下NO的氧化反应是可以发生的,而且反应会比较完全,剩余的 NO 量极少。但事实上,烟气中的 NO 与O2自发发生氧化反应的转化率极低。这是因为除了反应热力学外,NO氧化反应的转化率还要受到反应动力学的影响。在均相内,NO 的氧化反应为三级反应,其反应速率方程如下所示,式中rNO为反应速率,k为反应速率常数。
表1 NO 氧化反应的半衰期与 NO 浓度的关系
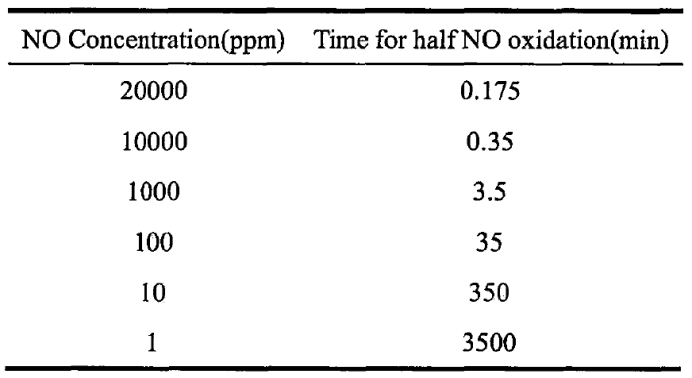
在整个反应过程中,两种机理处于相互竞争的状态。低温下,第二种机理处于优势:而高温下,第一种机理处于优势。绝大多数反应的反应速率会随着反应温度的升高而升高,但当反应温度低于 327℃时,NO与O2反应的反应速率却随着反应温度的升高而降低。这是因为低温下,NO 与O2反应遵循第二种机理。在第二种机理中,反应(1-3)为快反应,其很快达到反应平衡,而反应(1-24)为慢反应,所以总反应速率由反应(1-4)所决定,总反应速率 d(NO2)/dt=k[(NO)2]*[O2]。式中k为反应(1-4)的反应速率常数,其值随反应温度的升高而增加。由于反应(1-3)是一个放热反应,其反应平衡常数K随反应温度的升高而减小,K=[(NO)2]/NO2。将反应(1-3)的平衡关系式代入反应(1-4)的速率表达式,得到 d(NO2)/dt=k*K[NO]2*[O2]。当反应温度升高时,K值增加,k 值减小。故总反应速率降低,反应表现为负温度效应。而高温下,NO与02反应又遵循第一种机理,反应表现为正温度效应。
参考文献:
[1]朱世勇主编.环境与工业气体净化技术[M].北京,化学工业出版社.2001.
[2]Despres J, Elsener M, Koebel M, et al. Catalytic oxidation ofnitrogen monoxide overPt/SiOz[Jl. Applied Catalysis B:Environmental. 2004,50(2):73-82
[3]刘华彦.NO 的常温催化氧化及碱液吸收脱除NOx过程研究[D].杭州:浙江大学.2011.
[4]0lbregts J. Termolecular reaction of nitrogen monoxide and oxygen: A still unsolvedproblem[J]. International Journal of chemical kinetics. 1985,17(8):835-848
[5]严宣申:NO和 O2的反应[J].化学教育:2002,23(7):84-84
[6]姚瑞.改性活性炭低温催化氧化NO的研究[D].华东理工大学,2015.
